恶性肿瘤是危害人类健康的重大疾病。起源于我国并具有悠久历史的中医学,在当前的恶性肿瘤治疗中发挥着越来越重要的作用。然而,中医肿瘤治疗中使用的中药,其发挥抗肿瘤活性的有效成分及作用机制尚不明确,因而阻碍了中医药的现代化和国际化进程。近些年的研究表明,代谢重编程是肿瘤的核心恶性特征,并在肿瘤的发生发展中发挥重要作用。从代谢调控角度开展研究,将为解析中药抗肿瘤的分子机制提供新的思路。
上海中医药大学附属龙华医院、上海市中医药研究院中医肿瘤研究所陈文连、贾立军联合团队,选取中药女贞子中含量高的抗肿瘤活性成分——齐墩果酸(Oleanolic acid, OA),针对其下游代谢靶点以及相关的分子调控机制,开展了深入研究。近期,联合团队以研究论文形式在分子治疗领域的国际权威期刊《Molecular Therapy—Oncolytics》(IF 7.2)上发表了最新研究成果:Oleanolic acid blocks the purine salvage pathway for cancer therapy by inactivating SOD1 and stimulating lysosomal proteolysis。

联合团队首先利用体外细胞模型和体内小鼠模型,证实了OA的抗肿瘤活性以及体内用药安全性。接着,通过代谢组学分析发现,OA给药可快速(< 8小时)改变肿瘤细胞的代谢谱,尤其是显著抑制嘌呤补救合成通路。该代谢通路可为细胞提供多种核苷,用以满足肿瘤细胞快速增殖对核苷的大量需求。联合团队进一步研究发现,回复肿瘤细胞中的嘌呤补救合成活性,可明显逆转oa对细胞的dna复制和增殖的抑制效应。这些证据证实,嘌呤补救合成通路是oa的关键下游代谢靶点,oa需要通过抑制该代谢靶点来发挥抗肿瘤活性。
接下来,联合团队对OA调控嘌呤补救合成通路的分子机制开展了深入研究。联合团队发现,OA进入细胞内后,在短时间(< 8小时)内依次诱导下述分子事件的发生:(1)选择性抑制超氧化物歧化酶1(sod1)活性;(2)上调胞内的活性氧簇(ros);(3)激活ampk、抑制mtorc1;(4)激活自噬/溶酶体降解通路;(5)降解嘌呤补救合成通路中的关键酶hgprt和5'-nt;(6)最后下调嘌呤补救合成通路活性,从而抑制肿瘤细胞的dna复制和恶性增殖。
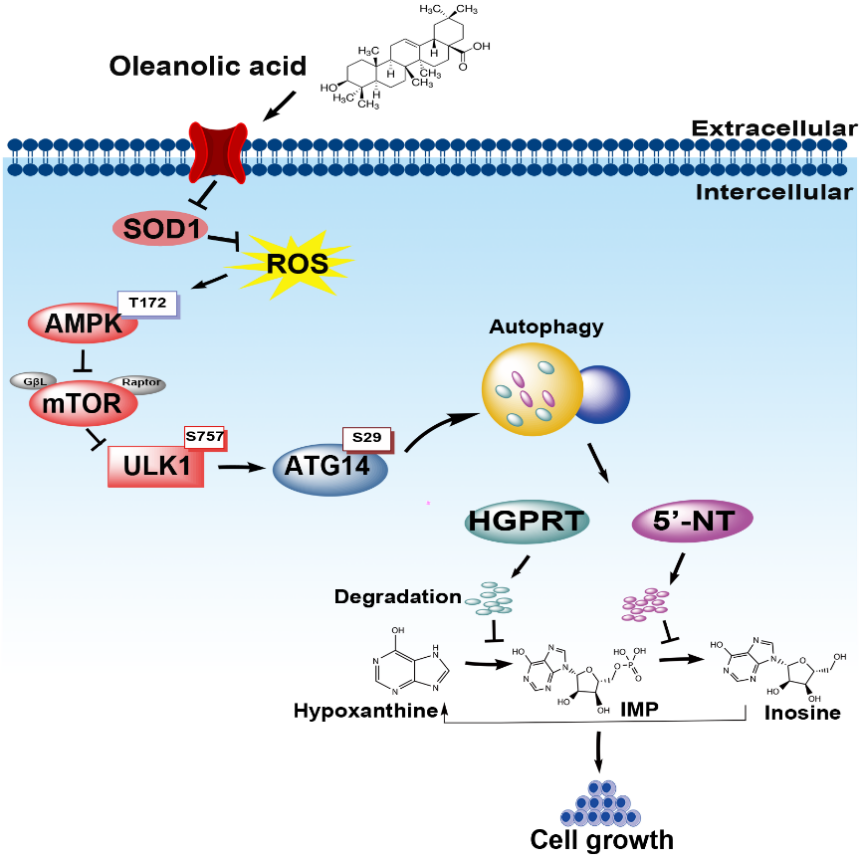
最后,联合团队对本课题发现的OA的代谢新靶点开展了临床相关性研究。联合团队入选3个肺癌患者队列和1个乳腺癌患者队列,分别从嘌呤补救合成通路的关键代谢酶表达、关键代谢酶活性和嘌呤/核苷代谢物丰度层面,证实患者肿瘤组织中的嘌呤补救合成活性被显著激活。同时发现,肿瘤组织中增强的嘌呤补救合成活性与患者的总生存呈负相关,也即指征患者预后不良。这些结果提示,嘌呤补救合成通路是肿瘤治疗的潜在新靶点。
联合团队通过上述研究,揭示了中药活性成分OA发挥抗肿瘤活性的下游关键代谢靶点为嘌呤补救合成通路,并阐明了OA调控该代谢靶点的分子机制。本论文的结果还提示,OA可能适用于治疗那些具有高水平嘌呤补救合成活性的肿瘤。总之,本论文为深入理解中药及其活性成分的抗肿瘤分子机制及其适应症特征,提供了一个非常有参考借鉴价值的新思路。
我院规培住院医师刘丹和助理研究员金星为本论文的共同第一作者。我院陈文连研究员和贾立军研究员为本论文的共同通讯作者。
通讯作者简介
陈文连 研究员

陈文连,博士,上海中医药大学附属龙华医院研究员,上海市中医药研究院中医肿瘤研究所基础研究部主任。上海高校特聘教授(东方学者),上海市青年拔尖人才,上海市青年科技启明星,上海中医药大学讲席教授。获上海市卫生系统第十七届银蛇奖二等奖。陈文连研究员长期从事“恶性肿瘤的代谢重编程”和“抗癌中药/中药活性成分的筛选及其药效分子机制”研究。迄今在Cancer Cell、Clin Transl Med、Signal Transduct Target Ther、Blood、PNAS、JCI Insight等国际权威期刊发表了系列创新性研究论文,并获邀担任Frontiers in Genetics等国际学术期刊的客座编辑。
贾立军 研究员

贾立军,博士,上海中医药大学附属龙华医院研究员,上海市中医药研究院中医肿瘤研究所所长,上海中医药大学首席教授,国家杰出青年科学基金获得者,教育部长江学者特聘教授,科技部中青年科技创新领军人才。贾立军研究员团队长期从事“抗肿瘤分子靶点发现与靶向药物设计筛选”和“恶性肿瘤发病机制与中西医干预策略”研究。迄今在J Natl Cancer Inst(JNCI)、Autophagy、Cancer Res、Clin Cancer Res、Cell Death Differ、Mol Cancer、Oncogene等期刊发表SCI文章50余篇、参编英文专著4部,获邀担任Signal Transduct Target Ther等多个国际学术期刊编委。
|